ARTICULO PARA COLEGAS
Estudios Moleculares de Genes Relacionados con Trombofilia
La trombosis es una enfermedad multifactorial que puede ser influenciada por la presencia de factores genéticos y adquiridos, los cuales pueden ocurrir en simultáneo o por separado. Actualmente la evaluación de los factores de riesgo genéticos asociados con un aumento en el riesgo de sufrir un evento trombótico se han convertido en una herramienta de suma importancia en el diagnóstico de estas patologías. Los más estudiados son las deficiencias de antitrombina, Proteína C y Proteína S (que se realizan por métodos coagulométricos o cromogénicos) y los genes de Factor V, Factor II, Metilentetrahidrofolatoreductasa (MTHFR) y Inhibidor de Activador del Plasminógenos Tipo I (PAI-1) cuyos polimorfismos se estudian con técnicas moleculares.
Factor V
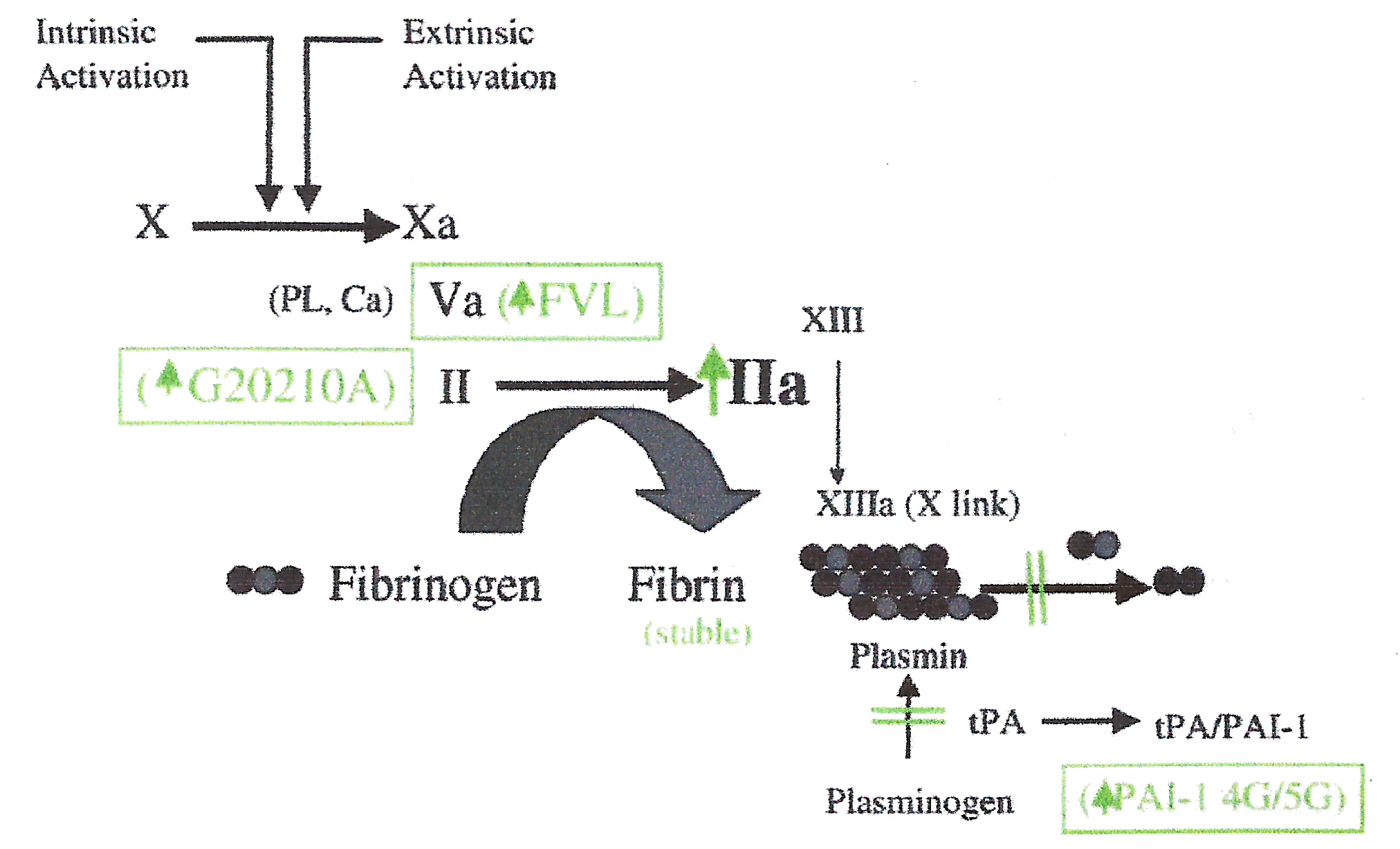
La mutación del Factor V, denominada Factor V Leiden, es el defecto genético más común que produce trombosis en la población caucásica, con una frecuencia que va del 2 al 15%. Se presenta como autosómica dominante, donde el portador heterocigota de la mutación tiene un riesgo incrementado en 3-8 veces de sufrir trombosis, mientras que en el homocigota el riego es 80 veces mayor.
En el FV Leiden se produce un cambio de bases en la posición 1691 ubicada en el exón 10, donde una G es reemplazada por una A (G1691A), produciendo así una sustitución en el aminoácido 506 de una Arginina por una Glutamina (R506Q). Este cambio de aminoácido se produce en el sitio de clivaje de la proteína, donde se une a la Proteína C Activada (PCA) disminuyendo la inactivación del FV y lleva al paciente a un estado de hipercoagulabilidad, con lo cual se aumenta el riesgo de sufrir un evento trombótico.
Factor II
La mutación del Factor II se describe con alta prevalencia en familias con trombosis y se hereda en forma autosómica dominante. Este gen se encuentra en el cromosoma 11 y posee 14 exones y 13 intrones. En este caso lo que ocurre es el reemplazo de una G por una A en la posición 20210, en la región 3´ donde se añade la cola de poli-A al ARNm incrementando su estabilidad, lo que se traduce en un aumento de los valores de Protrombina sérica. Una persona con un genotipo heterocigota tendrá los valores de protrombina elevados en un 30% y un homocigota en un 70%.
PAI-1
Otro factor genético relacionado a trombosis el PAI-1 (Activador del Inhibidor del Plasminógeno), el cual tiene una actividad central en la formación de trombos estables. El polimorfismo del gen 4G/5G en la región promotora influye en la expresión del mismo. A pesar de que ambos alelos se unen a un activador transcripcional, el alelo 5G también se une a un represor. En ausencia del represor, como ocurre antre la presencia del alelo 4G, se observa un incremento basal de la transcripción de PAI-1. Así, el homocigota 4G/4G está asociado con una concentración en plasma más elevada, y por lo tanto un estado procoagulante.
Diagn Mol Pathol - Volume 14, Number 4
MTHFR
Los niveles elevados de Homocisteina se asocian también con un aumento en el riesgo de sufrir un evento trombótico. La hiperhomocisteinemia se puede deber a un defecto en el gen de la MTHFR, que se encuentra en el cromosoma 1, y podemos encontrar dos mutaciones puntuales. Una en posición 677 donde una C es reemplazada por una T (Ala226Val) resultando en una enzima con un 50 % de actividad y termolábil. Otro polimorfismo se encuentra en la posición 1298 y se intercambian una A con una C quedando en la proteína final un residuo de Alanina en lugar de uno de Glutámico. Ambas mutaciones conllevan una reducción en la actividad enzimática. En los genotipos homocigotas T/T y C/C y los heterocigotas compuestos se observan niveles elevados de homocisteína plasmática. En el caso de los genotipos homocigotas wild type o heterocigotas simples la concentración de la homocisteína plasmática no se ve afectada. Esta determinación se sugiere cuando se presenten valores elevados de homisteína y habiendo descartado inicialmente causas adquiridas de hiperhomocisteinemia como deficiencias de B12 y fólico. Una de las explicaciones de por qué una homocisteinemia puede llevar a un evento trombótico se basa en que la homocisteína o alguno de sus metabolitos podrían actuar como agentes trombogénicos afectando la expresión de trombomodulina, la activación de la proteína C, aumentando la agregación plaquetaria y la producción de tromboxano.
La disminución de la actividad en esta enzima que conlleva al aumento de la homocisteína plasmática se ha relacionado con otras patologías como defectos en el desarrollo del tubo neural y distintos tipos de cáncer (colorrectal, gástrico, esofágico, etc).

Diagn Mol Pathol - Volume 14, Number 4
En el momento del embarazo hay que tener un especial cuidado con las mujeres que sufren trombofilia o que poseen factores que aumentan el riesgo de desarrollarla, ya que el balance entre la formación y la destrucción de coágulos es más delicado debido a que se producen cambios estructurales en los vasos sanguíneos y en el flujo sanguíneo. Las células de la placenta se desarrollan dentro de los vasos uterinos maternos modificandolos para que se conviertan en una zona de baja resistencia proporcionando así una adecuada irrigación. En este punto cualquier desbalance puede desencadenar en un evento trombótico que puede llevar a un aborto o una preeclampsia.
Las mujeres también deben tener cuidado ya que se ha demostrado que algunos anticonceptivos, las terapias de reemplazo hormonal, los esteroides sexuales y los tratamientos de fertilización in vitro, aumentan los riesgos de sufrir una trombosis venosa profunda. Por tal motivo sería recomendable que antes de comenzar cualquiera de estas terapias se hagan los estudios pertinentes para asegurarse de no poseer ninguno de los factores genéticos, ya que así se aumenta mucho más los riesgos de sufrir algún evento trombótico.
Diagnóstico
Ante la sospecha de una trombosis venosa profunda el médico puede solicitar una ecografía Doppler. Si en ella no puede verificar la obstrucción se puede realizar una flebografía, la cual se realiza con contraste. En algunos casos puede ser de utilidad la Tomografía Computada y la Resonancia Magnética Nuclear.
Desde el laboratorio es importante la determinación de dímero D en el diagnóstico inicial y las pruebas de coagulación básicas.
Si se sospecha una causa genética o si se es familiar de algún paciente con trombofilia se debería solicitar el estudio de los genes mencionados para corroborar si no es portador de algunas de las mutaciones que aumentan los riesgos de padecer estos eventos. La presencia de cualquiera de estas mutaciones se realiza sobre una muestra de ADN extraído de sangre periférica y las técnicas más utilizadas son PCR-RFLP o Real Time PCR con análisis de curvas de melting. A su vez el perfil suele incluir determinación de Antitrobina III, Proteína S y S libre y Proteína C.
Para descartar causas adquiridas se incluye Anticoagulante Lúpico y anticuerpos anti-cardiolipinas, anti-fosfolípidos y anti-beta2 glicoproteína.
Tratamiento
El tratamiento de los pacientes que han sufrido un evento trombótico, o de aquellos que están en riesgo de sufrirlo se realiza mediante la administración de fármacos anticoagulantes de forma crónica. Uno de los anticoagulantes más utilizados son los cumarínicos, la warfarina y el acenocumarol, que se administra por vía oral y el cual tarda unos días en ser efectivo. Debido a esto inicalmente se utilizan terapias por vía inyectable, como la heparina intravenosa, la cual actúa más rápidamente y se prefiere para pacientes hospitalizados. En la actualidad, también se utilizan heparinas de bajo peso molecular (HBPM) que se administran en forma subcutánea en el abdomen. Este tratamiento es de elección como prevención en pacientes embarazadas que sufren de trombofilia para evitar complicaciones.
Referencias
- Genetics and Molecular Pathophysiology of Thrombotic States. Intech 2013, Chapter 1.
- Factor V Leiden and other coagulation factor mutations affecting thrombotic risk. Clin. Chem. 1997; 1678-1683.
- Molecular Genetic Testing of Polymorphisms Associated With Venous Thrombosis. Diagn Mol Pathol 2005; 193-202.
- Thrombophilias and gynaecology. Best practice & Research Clinical Obstetrics & Gynaecology 2003; 509-528.
- Technical standards and guidelines: Venous thromboembolism (Factor V Leiden and prothrombin 200210G>A testing): A disease-specific supplement to the standards and guidelines for clinical genetics laboratories. ACMG Standards and Guidelines 2005; 444-453.
- Mutações predisponentes à trombofilia em indivíduos de Minas Gerais - Brasil com suspeita clínica de trombose. Revista brasilera de Hematología y Hemoterapia 2009; 19-24.
- Analysis of factor V Leiden and prothrombin mutations in patients with suspected thrombophilia in São Paulo state-Brazil. J Bras Patol Med Lab 2013, 169-173.
- Coexistencia de las mutaciones C677T y A1298C en la enzima 5,10 metilentetrahidrofolato reductasa en pacientes pediátricos con trombosis. Boletín Médico Hospital Infantil Mexico 2009; 229-233.
- Endothelial function and germ-line ACE I/D, eNOS and PAI-1 gene profiles in patients with coronary slow flow in the Canakkale population: multiple thrombophilic gene profiles in coronary slow flow. Cardiovasc J Afr 2014; 9-14.
- A Common Mutation A1298C in Human Methylentetrahydrofolate Reductase Gene: Associatios with Plasma Total Homocysteine and Folate Concentrations. American Society for Nutritional Sciences 1999; 1656-1660.
- Methylenetetrahydrofolate reductase and neural tube defects. The Lancet 1996; 58.
- MTHFR gene polumorphism and severe toxicity during adjuvant treatment of early breast cancer with cyclophosphamide, methotrexate, and fluorouracil (CMF). Anuals of Oncology 2000; 373-374.
- The MTHFR 1298CC and 677TT genotypes hav opposite associations with red cell folate levels. Elsevier 2006; 290-293.
Dra. Florencia Garaventa
Departamento de Biología Molecular
IBC Instituto de Bioquímica Clínica
LCHI Laboratorio Central Hospital Italiano Dr. José A. Scrigna