ARTICULO PARA COLEGAS
Perfil Férrico: Nuevos Marcadores Bioquímicos de Utilidad en la Práctica Clínica
Introducción

El dosaje único y aislado de Fe sérico no tiene valor desde el punto de vista del tratamiento clínico de un paciente debido a su gran variabilidad analítica. Su medida, en conjunto con el estudio del hemograma completo, que incluya la evaluación de los Índices Hematimétricos (VCM, CHM, CHCM y RDW) y remarcando la importancia de la observación microscópica de la morfología sanguínea, Recuento de Reticulocitos (Ret), la medida de la Capacidad Total de Fijación del Hierro (CTFH) y la Saturación de Transferrina (SaT), es imprescindible como base de estudios posteriores para la detección y seguimiento de anemias y sobrecargas de Fe. Los estudios secundarios incluyen como primera elección la medida de la Ferritina sérica (Ft) a la que seguirá la determinación de otros marcadores como pueden ser la Protoporfirina Eritrocitaria Libre (PEL), Receptores de Transferrina (RTf), Índice RTf /logFt, Eritropoyetina (EPO), que complementan este estudio para la confirmación diagnóstica sin dejar de lado el interrogatorio al paciente y la anamnesis clínica por parte del médico.
El desequilibrio de los mecanismos de regulación dependientes de la concentración de Fe puede originar trastornos hematológicos como ciertas anemias o estados de sobrecarga de Fe cuya exploración, por medio del "estudio del estado del hierro", permite llegar al diagnóstico más confiable y preciso.
Para el diagnóstico de ferropenia, una de las entidades de mayor frecuencia, la primera alteración que nos orienta en el estudio del "estado del hierro" es la hipocromía y la microcitosis observada al microscopio, que juntamente con los datos completos del hemograma son el paso inicial para pensar en un déficit de Fe. Resultados aportados por los parámetros complementarios, definirán si se trata de una Anemia por Déficit de Hierro (ADH), de otro tipo de anemia o de otra patología hematológica, lo cual indicará la elección adecuada del tratamiento en cada caso.
Respecto al hallazgo de un exceso de Fe, la confirmación del diagnóstico se realizará por estudios genéticos, siendo importante el seguimiento por los estudios bioquímicos una vez iniciado el tratamiento de la sobrecarga. También se debe tener en cuenta la alteración de pruebas hepáticas y la posibilidad de realizar una biopsia hepática. La tinción de una biopsia de médula ósea con azul de Prusia, es el estándar de oro como prueba directa para identificar la deficiencia de Fe, pero la aspiración de médula ósea al ser un método invasivo tiene poca frecuencia de uso.
Destacamos la necesidad de medir más de un marcador del "estado del hierro", especialmente para establecer el diagnóstico de una deficiencia de Fe, pues no solo aumenta la probabilidad de una correcta clasificación sino que también aumenta el porcentaje de probabilidad de definirla y estimar su prevalencia en poblaciones con alta incidencia de la misma. En la actualidad los parámetros sugeridos a partir de su incorporación en metodologías automatizadas son:
- Recuento de reticulocitos automatizados que brindan información adicional en cuanto a la cc de hemoglogina reticulocitaria (RetHe/ CHR) y fracción de reticulocitos inmaduros (IRF)
- Receptores solubles de Trasnferrina (sRTf)
Homeostasis del Fe
El hierro es esencial para la vida, ya que participa de casi todos los procesos de oxidación-reducción ( Ez del ciclo de Krebs, de la respiración celular y como transportador de electrones en los citocromos) está presente en enzimas (catalasas, peroxidasas y oxigenasas) En personas con estado nutricional óptimo, aproximadamente el 65% se encuentra formando parte de la hemoglobina, 15% como parte de enzimas y mioglobina, un 20% como depósito y un pequeño porcentaje unido a la transferrina (TRA) como hierro circulante. El metabolismo incluye una serie de importantes procesos: regulación del hierro intestinal, transporte a las células, almacenamiento, incorporación a las proteínas y el reciclado del hierro desde los eritrocitos. La homeostasis del hierro se regula por los niveles sistémicos e intracelulares de hierro, basándose en los niveles de Fe plasmático que debe mantenerse a niveles suficientes para estar disponible para su uso. A nivel sistémico, se mantiene el equilibrio a través de la regulación de la captación de hierro del aparato intestinal, el reciclado desde los macrófagos y el intercambio con los depósitos de hierro en el hígado. El principal regulador de estos mecanismos es la Hepcidina, que actúa degradando a la Ferroportina, proteína exportadora de hierro.
La expresión de hepcidina está regulada por la disponibilidad sistémica del Fe (de depósito y sérico) y del estado inflamatorio e infeccioso del organismo: es así como por distintas vías de señalización
Fe depósito y sérico, inflamación, infección síntesis de hepcidina absorción Fe y Fe sérico
Hipoxia Eritropoyetina eritropoyesis síntesis de hepcidina absorción Fe
En el enterocito duodenal el Fe de la dieta es reducido al estado ferroso por la reductasa Citocromo B duodenal (CyTBD), transportado al interior celular por el Transportador de Metales Divalentes (DMT1). Se libera a circulación por acción de la Ferroportina (FPN). La Hefastina, en la membrana basal oxida nuevamente al hierro para que pueda ser captado por su proteína transportadora Transferrina . los hepatocitos toman el Fe libre ó unido a TRA a través de sus receptores (RTf) y modulado por la expresión de Hepcidina. Del total de Fe transportado, el 70-90% es captado por las células eritropoyéticas; siendo los eritroblastos basófilos las células inmaduras con mayor concentración de RTf. El Fe macrofágico procede siempre del catabolismo hemoglobínico, y se deposita como ferritina y/ó hemosiderina y es liberado progresivamente al plasma. Tanto el depósito de Fe como su liberación a circulación son procesos rápidos. Del total de Fe que se moviliza diariamente sólo se pierde una pequeña proporción a través de las heces, sudor y orina. La reposición de esta pequeña cantidad se hace a través de la ingesta.
Nuevos Marcadores de Utilidad
Las deteminaciones de laboratorio comúnmente utilizadas para estimar el estado de hierro varían en sensibilidad y especificidad y en algunos casos tienen limitado valor diagnóstico debido a que se modifican por otras condiciones, independientemente del estado de hierro, complicando su interpretación. Un aporte importante fue el descubrimiento del papel de los receptores de membrana de la transferrina en la captación del hierro por las células, su relación con la proteína transportadora y el papel de su receptor soluble como marcador indirecto del hierro disponible para la eritropoyesis.
Receptores Solubles de Transferrina (sRTf)
El receptor de transferrina es una glicoproteína dimérica transmembrana con un único puente disulfuro. Cada dímero es capaz de unir una molécula de transferrina diférrica a pH plasmático fisiológico. La internalización del complejo Fe-TRA-RTf es llevada a cabo por endocitosis. El N° total de RTf presentes en los eritroblastos en médula ósea es determinante para la captación de hierro. RTf sufre una proteólisis en un sitio específico de su dominio extracelular dando lugar a dos monómeros (sRTf) cuya cc se mide en suero ó plasma. Existe una relación constante entre el N°total de RTf y la cc de sRTf circulante ó sea que la cc en suero ó plasma es una medida indirecta de la cantidad total de RTf.
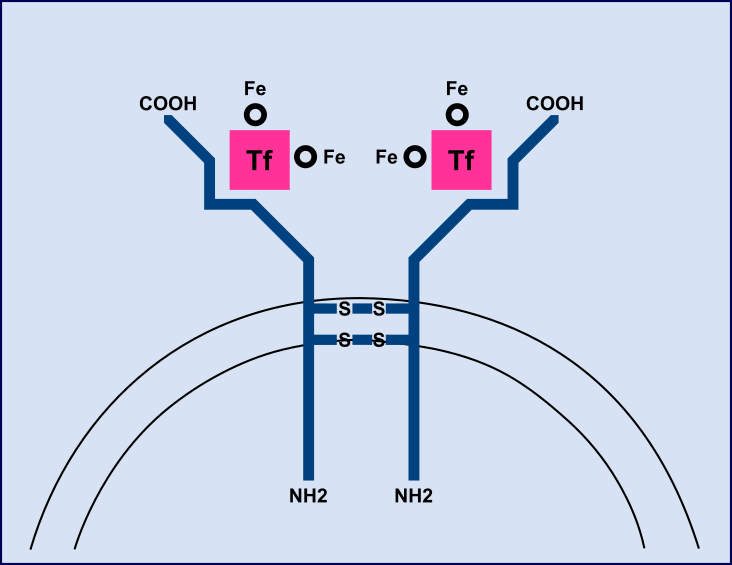
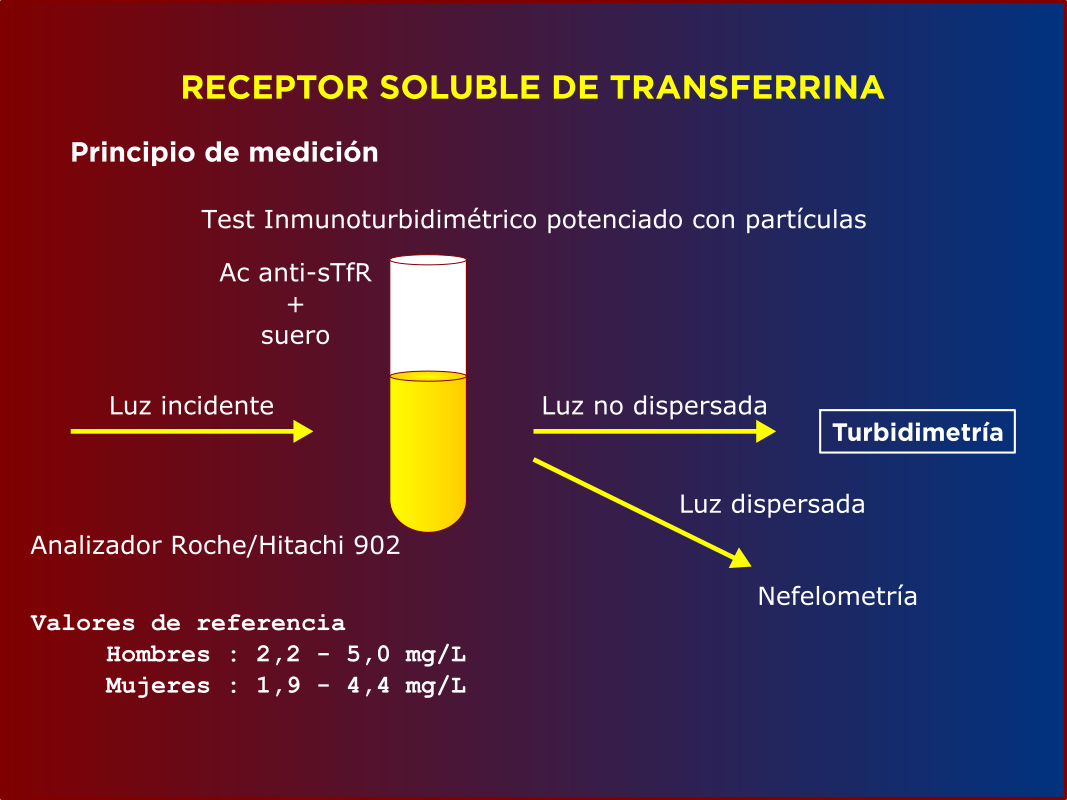
El dosaje se puede realizar por distintas metodologías: inmunoturbidimetría potenciada con partículas de látex con Ac monoclonales, inmunoensayo enzimático en fase sólida con sustrato cromogénico ó por quimioluminiscencia. Los valores de referencia dependen de la metodología. Se pueden expresar en mg/l ó nmoles/l
El receptor soluble de transferrina está presente en los reticulocitos y es liberado de la membrana cuando el reticulocito madura. En la deficiencia de hierro se produce un aumento proporcional del número de receptores de transferrina siendo un marcador precoz que permite diferenciar, además, anemia ferripriva de la anemia de enfermedad crónica. El receptor soluble de transferrina ofrece la ventaja, para evaluar el estado de hierro celular, de no alterarse en situaciones de enfermedad aguda o crónica. Algunos investigadores sostienen que los receptores solubles de transferrina cuantifican el hierro funcional con una eficiencia diagnóstica comparable a la histoquímica medular.
Este receptor tiene una alta sensibilidad y especificidad en la detección de la deficiencia de hierro. Este parámetro se eleva en deficiencia de hierro incluso antes de que la Hb tenga una reducción significativa; con la gran ventaja de que no se altera en los procesos infecciosos e inflamatorios agudos o crónicos como sí se alteran la ferritina sérica y la protopofirina libre eritrocitaria; sensibles a cambios circadianos y a la presencia de procesos agudos inespecíficos. Por lo tanto, se propone la utilización de los receptores de transferrina como análisis bioquímico ideal para realizar el diagnóstico de deficiencia de hierro.
La utilidad clínica de la determinación del receptor soluble de transferrina radica en su utilización para diferenciar la anemia por deficiencia de hierro con respecto a otros tipos de anemia.
Se observan valores elevados en la policitemia, anemia hemolítica, megaloblástica, falciforme, SMD. Durante el embarazo la ccsRTf está aumentada si existe una deficiencia de hierro funcional. Pueden observarse valores disminuídos en déficit congénito de Transferrina, cuadros tumorales, insuficiencia hepática crónica, neoplasias hematológicas.
Dado que sRTf es un indicador de disponibilidad de Fe, mientras que la Ft es indicador de depósito, la combinación de ambos parámetros en el índice sRTf/log Ft provee una mejor estimación del estado férrico de los pacientes. Es un indicador de mejor sensibilidad y especificidad, particularmente en presencia de enfermedades inflamatorias.
Recuento de Reticulocitos Automatizados
Los reticulocitos son glóbulos rojos inmaduros, con contenido de ARN y síntesis de Hemoglobina (Hb). Dicho contenido precipita con determinados colorantes in vitro, dando lugar a hematíes con imágenes reticulares y filamentosas en su interior, visibles al microscopio en un frotis y que dieron lugar al nombre de éstas células. El proceso normal de maduración es en médula ósea (aprox. 2 días) y los estadios finales están asociados con la maduración en circulación (1-3 días) Aunque no tienen ADN detectable, los reticulocitos más tempranos tienen grandes cantidades de ARN residual y organelas subcelulares asociadas con síntesis proteica. Así como la maduración de los reticulocitos progresa, su contenido de RNA disminuye. Corresponde a una población de hematíes macrocíticos hipocrómicos. La velocidad de producción de los reticulocitos está gobernada por las concentraciones de eritropoyetina.
Desde varias décadas atrás las técnicas de citometría de flujo en desarrollo y su aplicación en la detección y caracterización de subpoblaciones celulares hemáticas permitió la automatización del recuento reticulocitario. Son por tinciones con colorantes fluorescentes (naranja de thiazola, polimetina) y posterior lectura de intensidad de fluorescencia. Los CV obtenidos de diferentes contadores hematológicos dan prueba de una mayor precisión (CV < 12%). La muestra debe procesarse dentro del día de extracción, ya que el tiempo y la temperatura subestiman el resultado por maduración reticulocitaria. Pueden presentarse algunas interferencias como recuentos altos de leucocitos, plaquetas gigantes y agregados plaquetarios, parásitos, inclusiones celulares pero en general el contador hematológico los distingue sin dificultades. La ventaja de la automatización de esta práctica, es la estandarización de las condiciones de reacción por un lado e independencia del operador pero además permite la obtención de datos adicionales brindados que son de utilidad clínica para diagnóstico, seguimiento de los tratamientos, monitoreo de la respuesta medular por ejemplo en casos de transplante de MO.
Los parámetros reticulocitarios adicionales que se obtienen mediante el recuento automatizado son:
-
Parámetros de inmadurez reticulocitaria. IRF - Fraccion de Reticulocitos Inmaduros IRF= MFR+HFR
Se considera un marcador precoz de la actividad eritropoyética. De acuerdo a la intensidad de la fluorescencia, dada por la magnitud de la tinción y su contenido de RNA, se obtienen las tres poblaciones siguientes:
- LFR: Ret. de baja fluorescencia (más maduros),
- MFR: Ret. con mediana fluorescencia y
- HFR: Ret. con mayor fluorescencia, mayor contenido de RNA (más inmaduros)
Parámetros de Hemoglobina reticulocitaria. RET-He - Hemoglobina reticulocitaria equivalente/CHR
Mide la incorporación de hierro en el eritrocito. Proporciona una evaluación directa de la actividad de la médula ósea. Desde el punto de vista clínico posee la misma utilidad que CHR (cc Hb reticulocitaria) y se expresa en iguales unidades. Ante un grado de deficiencia de hierro, este valor se encuentra disminuido. Como dijimos, los reticulocitos son los precursores de los eritrocitos, por ello en casos de déficit de hierro, las primeras células que se anemizan son los reticulocitos. El grado de deficiencia de hierro, estaría representado por el parámetro RET-He.
Este parámetro es superador como marcador respecto de los parámetros clásicos como son la ferritina, hierro sérico y transferrina, ya que es prácticamente insensible a procesos inflamatorios y no tiene variaciones diarias.
En el laboratorio hemos determinado el valor de corte de nuestra población de pacientes para IRF y RET-He siendo:
IRF = Menor a 20%
Ret-He = Mayor a 25 pg
Ret% = Adultos 0,3% - 3,0%
Niños 2,0% - 6,0%
Recuento de reticulocitos: se puede expresar en valores relativos y/ó absolutos. El valor relativo es necesario corregirlo al valor de Hto del paciente. Nuestros valores de referencia son:
Retc= %Ret x Hto pacte / Hto normal para la edad del pacte.
Se puede calcular el IPR (Indice de producción de reticulocitos) que proporciona una estimación de la tasa de eritropoyesis efectiva, comparada con la tasa de maduración del reticulocito en sangre periférica correspondiente a un día.
IPR= Retc / vida media retic IPR 1,5 aumento de la actividad eritropoyética
Para Hto: 45 vida media= 1 día // Hto:35 1,5 // Hto: 25 2 // Hto: 15 2,5
Estados no fisiológicos
ADH. La anemia por falta de hierro está estrechamente ligada a carencias nutricionales, causada por el déficit del mismo en la cantidad y calidad de la dieta. Es una de las de mayor frecuencia a nivel mundial, siendo el mayor porcentaje visto en los países en vías de desarrollo.
- La mayor afectación se da en la niñez por las necesidades aumentadas por el crecimiento, adolescencia, en las mujeres en edad fértil por las pérdidas mensuales ó durante el embarazo. El niño presenta una anemia fisiológica en los primeros dos años de vida, se acrecienta con el menor peso al nacer y por la prematuridad. A veces persiste el cuadro de anemia hasta la edad escolar. Es importante el diagnóstico temprano por los efectos negativos en el desarrollo cognitivo, motor, en el comportamiento y crecimiento, en su sistema inmune. Consecuencias aveces irreversibles.
- A lo largo del embarazo, se dan distintas etapas donde el balance del Fe pasa de ser positivo al comienzo y negativo al final del embarazo, siempre dependiendo de las reservas de la paciente al inicio. La suma de los requerimientos del feto y de la placenta, más la expansión del volumen sanguíneo materno hacen que los requerimientos de Fe alcancen un máximo en un corto período de tiempo. Las riesgos de ADH se traducen en probabilidades de un bebé con bajo peso al nacer, hasta causas de mayor severidad tanto en la madre como en el feto.
- En el adulto las consecuencias de ADH son una baja productividad y rendimiento
En un primer estadío solo hay depleción de los depósitos (ferropenia latente) sin alteraciones morfológicas, seguido de un período donde hay ferropenia y ferritinemia (eritropoyesis ferropénica) sin anemia. Finalmente en el estadio de anemia ferropénica están todos los parámetros alterados. Si bien el descenso de la ferremia o hipoferremia es característico de la ADH, también puede observarse en todas aquellas situaciones que se acompañan de un bloqueo del Fe en las células del sistema mononuclear fagocítico, tales como los síndromes inflamatorios crónicos, enfermedades sistémicas y los procesos neoplásicos avanzados.
LABORATORIO
Hb disminuida (en un déficit avanzado)
GR MICROCITOS HIPOCRÓMICOS (índices hematimétricos disminuidos, RDW aumentado)
Fe sérico disminuido Ft disminuida Fe medular disminuido
SaT disminuida TRA/TIBC aumentada PEL aumentada
sRTf aumentados índice sRTf/log Ft aumentado Hep disminuida
N° Ret disminuido Ret-He/CHR disminuida
AEC. Anemia de enfermedades crónicas/ procesos inflamatorios. La circulación del Fe entre los compartimientos de depósito y de utilización constituye un ciclo muy eficiente y prácticamente cerrado y las concentraciones intracelulares del mismo están reguladas con gran precisión, porque tanto el exceso como la carencia de este mineral son nocivos para las células. La anemia se instaura por una desaceleración general de la eritropoyesis pues las citoquinas liberadas por los macrófagos tienen un efecto inhibidor sobre la eritropoyetina. Se origina una anemia normocítica de largo tiempo que cuando está muy evolucionada puede transformarse en microcítica, por retención de Fe por los macrófagos
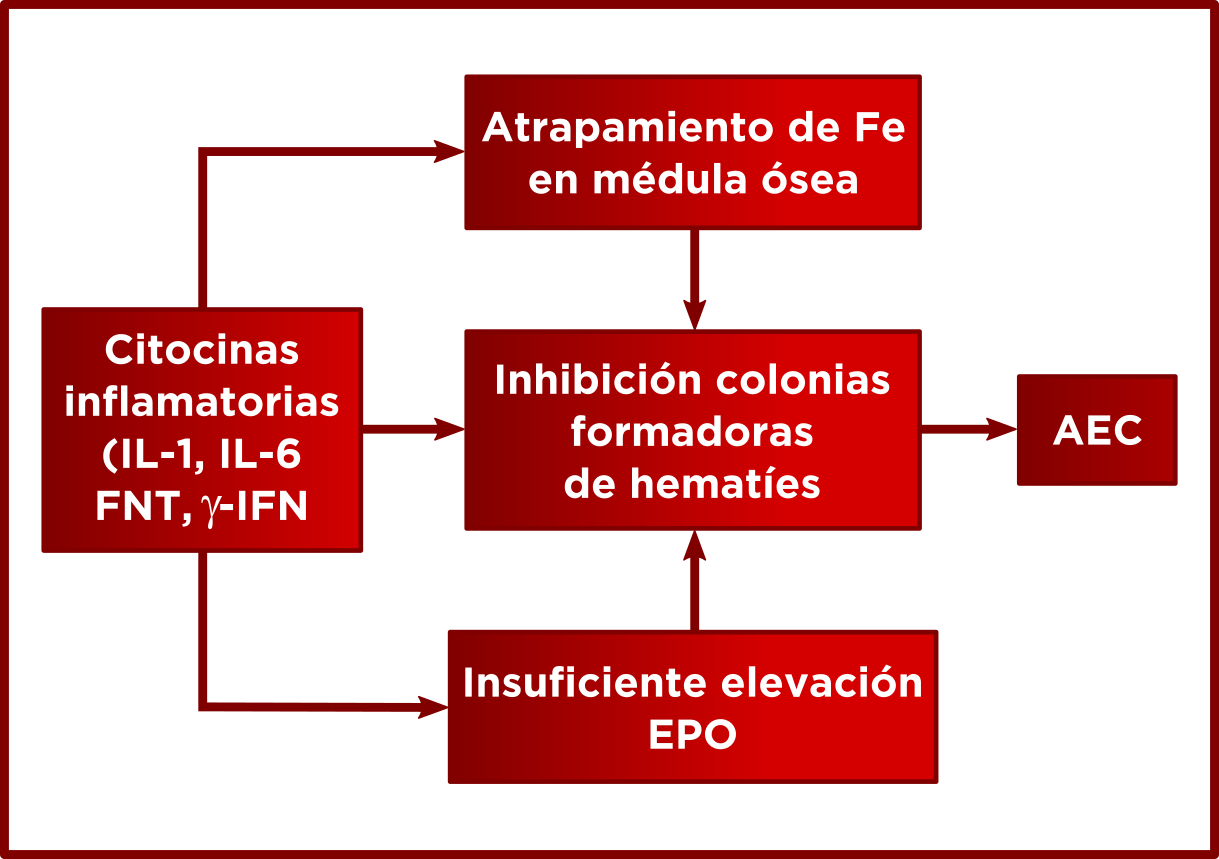
LABORATORIO
Anemia normocítica RDW normal
Fe disminuido TRA/TIBC disminuido SaT disminuida
Ft aumentada Hep aumentada Ret-He normal
sRTf normal o disminuido
Diagnostico diferencial
| ADH | AEC | AEC + Ferropenia | |
|---|---|---|---|
| Ferremia | muy disminuído | muy disminuído | muy disminuído |
| TIBC | muy aumentado | normal - disminuido | normal - disminuido |
| Ferritina | disminuida | normal - aumentada | aumentada - normal |
| sRTf | aumentados | normal - disminuidos | normal |
| Índice sRTf/logFt | aumentado | disminuido | normal - aumentado |
| Ret | disminuidos | normal | disminuidos - normal |
Hiperferremia. El exceso de Fe se deposita en las células parenquimatosas del hígado, corazón, páncreas, glándula pituitaria y glándula paratiroide y cuando la enfermedad progresa tiende a producir hepatomegalia, fibrosis y cirrosis hepática, en el corazón causa cardiopatías congestivas y arritmias. También se asocia a distintas endocrinopatías. En exceso de Fe, el diagnóstico diferencial de hemocromatosis se define en términos fenotípicos y las alteraciones genéticas muestran la susceptibilidad para su desarrollo. También, en este caso, la investigación debe iniciarse con el estudio del "estado del hierro" y completarse con estudios genéticos. La sobrecarga de Fe suele detectarse principalmente por el aumento de SaT y más tardíamente por el aumento de Ft. Los trastornos se deben a defectos fisiopatológicos del eje Hepcidina-Ferroportina; por alteración de la maduración eritroide (talasemias, anemia sideroblastica, SMD, etc)
| Anemia sideroblastica | Talasemia | Hemocromatosis | |
|---|---|---|---|
| Hb | disminuída | disminuída | aumentada |
| RDW | aumentado | normal | normal |
| Ferremia | normal - aumentado | normal - aumentado | normal - aumentado |
| Ferritina | aumentada | normal - aumentado | aumentada |
| SaT | normal - aumentada | normal | aumentada |
| Ret | disminuídos | normales | aumentados |
| hep | disminuida | disminuida | disminuida |
Distintos trabajos publicados demuestran que RET-He y receptores solubles de transferrina son los marcadores más precoces para detectar déficit funcional de hierro y anemia por déficit de hierro. Los índices permiten evaluar función eritropoyética, déficit funcional de hierro, monitorear la respuesta a tratamientos y post transfusional.
En cuanto a su uso en anemia por déficit de hierro se presenta con RET-He < 25 pg, depleción de los depósitos y del hierro funcional y hemoglobinización de glóbulos rojos. En pediatría se realizaron estudios analizando RET-He como diagnóstico de ferropenia. La conclusión indicó la mayor efectividad de RET-He que los índices convencionales para detectar déficit de hierro antes de su progresión a anemia. Estudios en pacientes adultos con neoplasias hematológicas y en tratamiento demostraron que RET-He es un parámetro útil para detectar déficit funcional de Fe y también de alta sensibilidad para detectar en forma temprana la eficacia del transplante de M.O. En pacientes sometidos a hemodiálisis se analizó RET-He para evaluar el estado del hierro; concluyéndose que RET-He < 26 pg es una medida segura del estado del hierro en pacientes en diálisis e indica el comienzo agudo de un déficit de hierro. En los pac. renales se encontró una débil correlación significativa entre el RST y el porcentaje de eritroblastos en médula ósea.
Bibliografía
- Algoritmos de laboratorio para el estudio del estado del hierro. Acta Bioquímica Clínica Latinoamericana.2013; 47(3):507-522
- Estudio del paciente con hiperferritinemia. Medicina y Laboratorio.2017; 23:411-442
- Receptores solubles de Transferrina como mejor indicador bioquímico para definir deficiencia de hierro. Acta Bioquímica Clínica Latinoamericana. 2010; 44(3):311-316
- Receptor soluble de Transferrina en anemia. Medicina. 2001: 61: 552-556
- Determinación del sRTf: su utilidad en el diagnóstico de las anemias. Hematología.2018; Vol22 N°2: 211 - 213
- Receptores séricos deTransferrina en Insuficiencia Renal Crónica. Nefrologia. Vol XIX N°5 1999
- Hemoglobina Reticulocitaria: un nuevo parámetro del hemograma de gran valor en el diagnóstico y manejo de la eritropoyesis deficiente de hierro. Medicina y Laboratorio. 2015; Vol 21. N° 1 y 2
- Nuevos biomarcadores del tratamiento férrico en el ieloma múltiple y anemia asociada a la enfermedad renal J. Clin. Med 2019; 8 (11):1828
- Reticulocyte hemoglobin measurement-comparison of two methodsmin the diagnosis of iro-restricted erythropoiesis. Clin Chem Lab Med 2005;43(11):1193-1202
- Poster Congreso Hematologia Nov. 2003 "Puede la Hb reticulocitaria diferenciar B-talasemia menor de Anemia Ferropenica?"
- Nuevos marcadores bioquímicos para el estudio de pacientes con anemia. Hematologia. 2017; Vol 21 N°extraordinario XXIII Congreso de Hematología: 126 - 136
Dra. Graciela Palma Area Hematología IBC Instituto de Bioquímica Clínica